A Assembleia Geral das Nações Unidas proclamou 2019 o Ano Internacional da Tabela Periódica, para comemorar os 150 anos desde que foi proposta por Dmitri Mendeleev. Este artigo relembra um pouco da sua história, escrita por químicos, e indica os caminhos presente e futuro, trilhados por físicos.
Como se aprende na escola, os átomos são estruturas que contém um núcleo de carga elétrica positiva, composto de um número (tradicionalmente denotado pela letra “Z”) de prótons e um número, “N”, de nêutrons, de tal forma que o número de massa atômica (“A”) é dado pela soma de Z+N. Os átomos são eletricamente neutros e esse fato se dá pela existência de um número de elétrons, de carga negativa, igual a “Z”, numa região chamada de eletrosfera, afastada do núcleo.
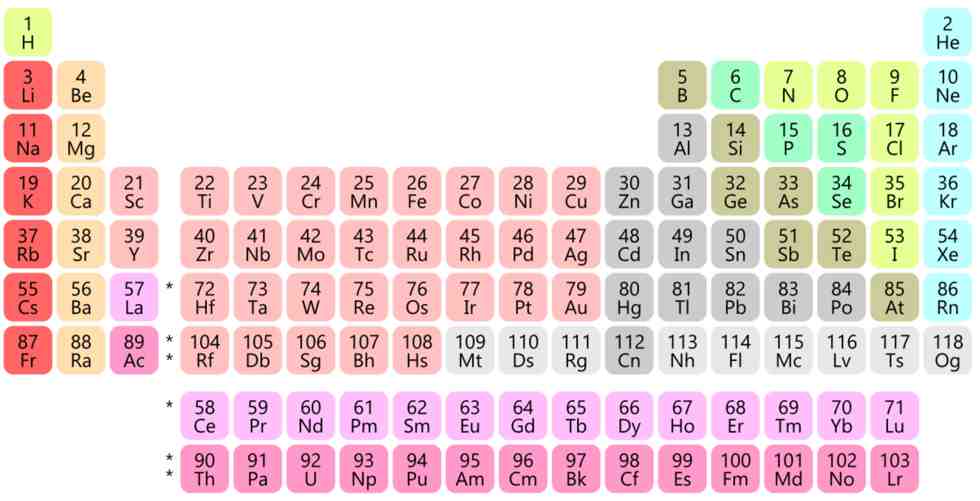
Os elementos químicos conhecidos estão dispostos na famosa tabela periódica de Mendeleev, que os classificou em função da existência dos isótopos de cada elemento e é mostrada na figura abaixo. Isótopos são átomos que têm a mesma carga nuclear, ou seja, mesmo número de prótons (Z), e que por isso são considerados representantes de um mesmo elemento químico, e ocupam o mesmo lugar na tabela periódica, imagem que abre este artigo.
A construção da tabela periódica baseou-se numa espécie de jogo de cartas do tipo paciência, que Mendeleev usou para tentar organizar as informações de que dispunha e eram, basicamente, as propriedades químicas e as massas dos diversos elementos químicos. No entanto, como muito menos elementos químicos eram conhecidos naquela época, o “baralho” estava incompleto e era difícil achar uma lógica adequada para arrumar as “cartas”.
Depois de dois dias sem dormir, Mendeleev acabou exaurido e dormiu por muitas horas. Segundo seus próprios relatos, ao acordar, tinha resolvido o quebra-cabeça. Os elementos foram dispostos em filas horizontais, em ordem crescente de massas atômicas e, ao mesmo tempo, em colunas verticais que reuniam propriedades químicas semelhantes. Uma tabela periódica interativa pode ser consultada neste link..
Os isótopos desempenham um papel importante nos processos nucleares que, como o nome diz, ocorrem no núcleo atômico, onde se encontram prótons e nêutrons.
Na natureza, elementos com diversos valores de Z são observados, mas só alguns são estáveis, isto é, sustentam núcleos atômicos que demoram muito para se desmanchar. Alguns têm uma duração que, na escala humana, pode ser considerada infinita.
Outros são instáveis, mas com uma meia-vida (tempo em que é altamente provável que metade dos átomos numa amostra se desintegre) longa (1.000.000.000 de anos, por exemplo), e outros ainda são muito instáveis, com meia-vida curta, que varia de poucos picos segundos (0,000000000001 segundo) a alguns anos. Há, aproximadamente, 280 isótopos estáveis e 67 instáveis, com vida longa, encontrados na Terra. No entanto, consegue-se produzir mais de 1.200 isótopos instáveis, com vida curta, em laboratório.
Todos os elementos com Z maior que o do urânio foram produzidos em laboratório, e foi justamente procurando elementos transurânicos (“para além do urânio”), que a fissão nuclear, o processo pelo qual um núcleo atômico se desfaz, foi descoberta. O uso tecnológico da fissão nos deu as usinas de energia nuclear e, também, as primeiras armas nucleares.
A procura por elementos ditos superpesados é uma área efervescente na física, e não mais na química. Em 1974, o elemento 106, nomeado como seaborgium, foi descoberto no Lawrence Berkeley Laboratory, nos Estados Unidos. Depois disso, outros 12 elementos superpesados foram descobertos, sendo seis na Alemanha e outros seis em Dubna, na Rússia.
É importante salientar que os novos elementos da tabela periódica são obtidos por meio de reações nucleares e, como têm uma meia-vida muito efêmera, são detectados indiretamente, por meio dos elementos mais leves que geram quando seus núcleos se desintegram. No momento, 118 elementos químicos diferentes existem, e há indícios de que outros dois já estão sendo sintetizados em aceleradores nucleares. O oganesson, de número de massa 118, foi nomeado em reconhecimento ao trabalho de Yuri Oganessian, um físico armênio ainda ativo, homenageado por seu país de origem com um selo no qual estão identificados os produtos da reação que permitem inferir a existência do elemento químico. O selo é mostrado na figura abaixo.

Como vimos, a tabela periódica tem sofrido inclusões e o número de elementos químicos duplicou desde Mendeleev, mas não se sabe ainda dizer qual é o elemento químico mais pesado que pode existir na natureza. Do ponto de vista da física nuclear, no entanto, há outro modo de organizar os mesmos elementos, desta vez, em função das suas propriedades físicas. Ao se construir um gráfico no qual os números de prótons são colocados no eixo horizontal e os números de nêutrons no vertical (ou vice-versa), obtém-se a carta de nuclídeos, mostrada na figura abaixo.
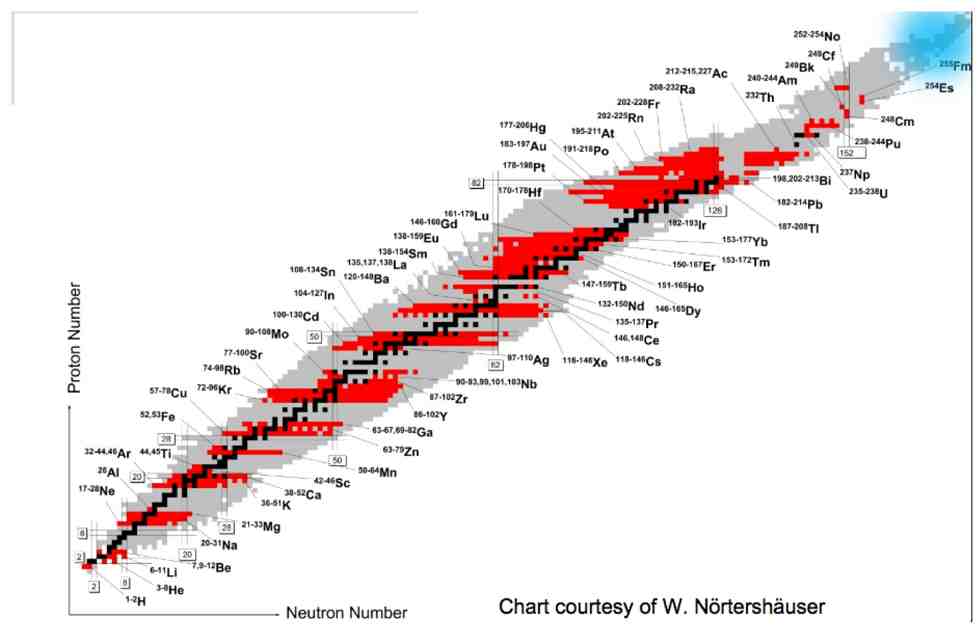
As medidas experimentais demonstram que os nuclídeos – os pontos do gráfico que correspondem a elementos reais – não aparecem distribuídos de forma aleatória, mas ao longo de uma região bem definida. Para pequenos valores de Z e de N, essa região é quase uma reta na qual os valores de ambos estão próximos, mas conforme os valores de Z e N aumentam, a região ocupada pelos nuclídeos prioriza valores de N cada vez maiores do que Z. As famílias isotópicas (mesmo número de Z) e isotônicas (mesmo número de N) podem conter várias nuclídeos.
Os nuclídeos estáveis aparecem no centro da região ocupada, geralmente numa cor mais escura. A maioria absoluta dos nuclídeos é instável, uma vez que tende a se transformar (decair) em outros nuclídeos com o passar do tempo, seja por emissão ou por absorção de partículas. Uma carta de nuclídeos interativa pode ser consultada aqui.
Os elementos superpesados, discutidos acima, aparecem no canto superior direito da carta. De acordo com um importante modelo da física nuclear conhecido por modelo de camadas, os núcleos que contêm N ou Z ditos “mágicos” (2,8, 28, 50, 82 e 126) são mais estáveis e, portanto, deve existir uma ilha de estabilidade ainda não encontrada na região de N=184 e Z=114. Os físicos estão trabalhando intensamente para encontrá-la.
Débora Peres Menezes é Professora Titular do Departamento de Física da Universidade Federal de Santa Catarina, atual representante brasileira na Comissão de Física Nuclear (C12) da International Union of Pure and Applied Physics (IUPAP), membro do Comitê Gestor do INCT – Física Nuclear e Aplicações e membro da diretoria da Sociedade Brasileira de Física. Foi Pró-Reitora de Pesquisa e Extensão da UFSC de 2008 a 2012.
